Jakarta (ANTARA) - Badan Pengawas Obat dan Makanan (BPOM) RI menerbitkan Izin Penggunaan Darurat (Emergency Use Authorization/EUA) Vaksin InaVac produksi PT Biotis Pharmaceutical Indonesia untuk penggunaan dosis pertama dan kedua atau primer.
"Dengan penuh rasa syukur, hari ini BPOM mengumumkan adanya persetujuan penggunaan EUA vaksin COVID-19 produksi dalam negeri dengan nama InaVac, sebagai salah satu Vaksin Merah Putih," kata Kepala BPOM RI Penny K Lukito dalam konferensi pers Penerbitan EUA Vaksin Primer InaVac di Jakarta, Jumat.
Ia mengatakan vaksin berplatform inactivated virus dikembangkan oleh peneliti dari Universitas Airlangga (Unair) serta diproduksi oleh PT Biotis di fasilitas produksi yang berdomisili di Gunung Sindur, Kabupaten Bogor, Jawa Barat.
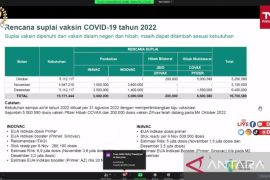
Vaksin primer InaVac disetujui untuk menstimulasi imunitas tubuh terhadap SARS-CoV-2 untuk pencegahan COVID-19 pada orang berusia 18 tahun ke atas.
Vaksin tersebut diberikan untuk dua dosis suntikan berinterval per suntikan selama 28 hari dengan efikasi yang setara dengan Vaksin CoronaVac.
Menurut Penny, Vaksin InaVac telah diuji dengan sejumlah varian terbaru virus Corona.
"Industri farmasi sudah berkomitmen memenuhi mutu dan dengan disetujuinya EUA vaksin InaVac atas nama PT Biotis untuk vaksinasi primer, maka sudah mulai mendukung kemandirian vaksin COVID-19 dalam negeri," katanya.
BPOM mengapresiasi Tim Ahli Komite Nasional Penilai Vaksin COVID-19 dan Indonesian Technical Advisory Group on Immunization (ITAGI) atas kerja sama dalam penelitian vaksin InaVac untuk digunakan masyarakat.
Menurut Penny produksi vaksin primer InaVac sudah berjalan dan akan dirangkai dengan peluncuran perdana untuk digunakan masyarakat dalam waktu dekat.
"Proses distribusinya ada di Kementerian Kesehatan karena akan ada pembelian dan pengadaan vaksin InaVac oleh pemerintah," katanya.